С осъзнаването на критичната роля на „неглежирания орган“ – чревната микробиота (ЧМ), за здравето и болестите при хората изгря нова ера в медицинската наука. Разбирането на нейното разнообразие, стабилност и устойчивост и влиянието на тези фактори върху здравето е изключително трудно. Въпреки че изследването на ЧМ е все още в начален етап, констатациите се считат за интригуващи, но и обещаващи. Запълването на пропастта в знанията за взаимоотношенията между ЧМ и организма и тяхната роля в патогенезата на болестта изисква по-задълбочени проучвания за разкриване на тази вълнуваща, но загадъчна област на изследване
Хората живеят в биосфера, в която заедно с микробите съществуват и еволюират вече над 3.8 милиарда години. Човешкото тяло се обитава от комплексна микробна общност, разположена в 4 основни екологични ниши – кожа, носоглътка и дихателни пътища, уро-генитален и гастроинтестинален тракт (ГИТ). Около 70% от всички микроорганизми се намират в ГИТ, по-специално в дебелото черво, вероятно поради наличието там на много ферментируеми субстрати. Гастроинтестиналната лигавица е най-голямата епителна повърхност, изложена на постоянното въздействие на вредни фактори от външната среда. Това прави ГИТ най-важната екологична ниша за организма.
Чревната микробиота
Понастоящем е известно, че червата са дом на изключително богата и динамична екосистема. Тя включва поне 500-1000 вида при всеки човек, с около 100 трилиона клетки, което надвишава 3 до 10 пъти броя на човешките клетки3,4. Колекцията от бактерии, дрожди, археи (примитивни едноклетъчни организми), еукариоти, гъби, протозои и неживи вируси (бактериофаги) се нарича „чревна микробиота“. Този термин трябва да бъде предпочитан пред по-стария термин „флора“, който отразява само бактериалните обитатели на червата. Бактериите представляват 90% от ЧМ и са най-добре проучените микроорганизми в чревната екосистема. Около 50% от фекалната маса се състои от бактерии. Повечето досегашни проучвания върху ЧМ са извършени с помощта на културелни техники. Недостатъците на култивирането са, че въпреки използването на специфични селективни среди и анаеробни инкубационни условия, до около 80% от ЧМ все още не е култивирана и идентифицирана. Ограниченията на културелно-базираните техники до голяма степен са преодолени чрез използване на новите молекулярни подходи. С развитието на високопроизводителна технология за секвениране на гени, изследването на ЧМ в момента включва два основни етапа: (1) 16S rRNA базирано секвениране на бактериален ген; и (2) биоинформационен анализ. Метаболомиката е друга бързоразвиваща се област на изследванията на ЧМ, която оценява малки молекули, асоциирани с взаимодействието между човешкия метаболизъм и бактериите, който има отражение върху здравето и болестите. Данните от проучването на ЧМ и метаболома понастоящем осигуряват най-мощните доказателства за тяхната връзка със здравето и различни болести1,5. От над 50 известни бактериални типа обикновено в червата има 6 типа: Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria Verrumicrobia и Fusobacteria, с преобладаване на първите два (90%)6. Съставени сме от 10% човешки клетки и 90% бактериални. Освен това, гените, кодирани от бактериалния геном, превишават около 150 пъти гените, кодирани от човешкия геном. Тези допълнителни гени са добавили различни видове ензимни протеини, които играят важна роля в улесняването на метаболизма на организма и по този начин допринасят за регулирането на човешката физиология7,8.
Развитие и състав на чревната микробиота
В дните и седмиците след раждането червата на детето придобиват своя микробиом и започва преходът към бактериално равновесие. Процесът на колонизиране на ГИТ е уникален пример за екологична приемственост, въпреки че все още не е напълно проучен. Счита се, че червата на бебето са стерилни или съдържат много ниско ниво на микроби преди раждането, така че колонизацията започва по време на раждането и продължава в постнаталния период9. Основните фактори, повлияващи ранните колонизационни процеси, са начинът на родоразрешение, гестационната възраст при раждането, начинът на хранене (кърмене или изкуствено), хигиенните условия и експозицията на антибиотици. При родените по естествен начин (вагинално) деца, ЧМ наподобява вагиналната флора на майката, с преобладаване на Lactobacillus, Prevotella. Микробиотата на родените чрез цезарово сечение деца е сходна с кожната микробиота, с доминиране на Staphylococcus, Corynebacterium, Propionibacterium. ЧМ на новородените се характеризира с ниско разнообразие и относителна доминация на Actinobacteria, Proteobacteria. Видът на храненето е друг фактор, повлияващ постнаталната колонизация на ГИТ. Няколко проучвания показват съществени разлики в състава на ЧМ между кърмените и изкуствено хранените бебета. Освен че отговаря на хранителните и физиологичните нужди на кърмачето, кърмата съдържа и няколко биологично активни съединения, които не се предлагат в изкуствените млека. Тези съединения имат важна роля в храносмилането и абсорбцията на хранителни вещества, имунната и антимикробната защита9-11. Здравето на майката също може да играе роля в микробното съдържание на кърмачетата: повишеният индекс на телесна маса (ИТМ) на майката е свързан с по-високи концентрации на фекални Bacteroides, Clostridium и Staphylococcus, както и по-ниски плътности на Bifidobacteria. Akkermansia muciniphila, Staphylococcus spp. и Clostridium difficile са по-ниски при бебета на майки, които са имали нормален ИТМ12.
През първата година от живота на детето съставът на ЧМ е сравнително прост и показва широки междуиндивидни вариации. Промените са постепенни и са свързани с промяна в режима на хранене от кърмене или изкуствено хранене, до отбиване и въвеждане на твърда храна. ЧМ става все по-разнообразна с появата и доминирането на Firmicutes и Bacteroidetes, които са характерни за ЧМ на възрастните13. До края на първата година от живота, микробният профил е различен за всяко дете; до 3-годишна възраст съставът на ЧМ напълно наподобява този на възрастните14. Този период на съзряване на ЧМ може да бъде критичен за човешкото здраве. Нормалната чревна колонизация е от жизненоважно значение за завършване развитието както на имунната система, така и на ГИТ. Оформянето на ЧМ на този ранен етап може да повлияе на здравето през целия живот на индивида. Съществуват много доказателства, че вредни въздействия в ранна детска възраст, като инфекции, антибиотици, лошо хранене и пр. може да причинят сериозни нарушения в чревната микроекология и да доведат до проявата на болести в по-късни периоди от живота10,11.15. През първите 3 години от живота микробното разнообразие се увеличава, за да достигне ниво, подобно на това в зряла възраст. При възрастни микробната общност обикновено е стабилна, но относителното изобилие от бактерии и микробното разнообразие може да претърпи динамични промени в резултат на взаимодействията с диетата, генотипа (епигенетичния състав) и физиологичното състояние на индивида10. Въпреки относителните сходства на ЧМ при майките и техните деца, микробните последователности в ГИТ се повлияват и от множество външни и вътрешни, свързани с организма фактори. Външните фактори включват микробното натоварване на непосредствената околна среда, вид на приеманата храна и хранителните навици, в допълнение към състава на майчината микробиота. Вътрешните фактори включват стомашна киселинност и чревно рН; микробни взаимодействия; чревна перисталтика; жлъчни киселини; прием на медикаменти10. Хората не притежават един и същи микробиом. Данните от проучването на човешкия геном и на бактериалния геном показват, че около 30% от ЧМ е обща за повечето хора, останалите 70% се срещат в уникални за всеки индивид конфигурации от специфични филотипове, подобни на пръстовите отпечатъци. Вътревидовите вариации между отделните видове в ЧМ са от много по-голямо значение, отколкото вариациите между ЧМ на отделните индивиди. ЧМ обаче е динамична система, която се променя в хода на живота на човека4,5.
Състав и луменни концентрации на основните микробни видове в ГИТ
В ГИТ могат да се открият два градиента на микробно разпределение, като количество, разнообразие и плътност: от проксимална към дистална посока на ГИТ и от лумена към чревната лигавица. Бактериалните клетки са неравномерно разпределени по протежение на ГИТ и тяхното количество и плътност нарастват от проксимална към дистална посока. Поради нормалната чревна перисталтика и антимикробните ефекти на стомашната киселина, жлъчната, панкреасната и чревната секреция в стомаха и проксималните тънкочревни отдели има относително малък брой бактерии при здрави лица16. Микробиологията на терминалния илеум представлява преходна зона между йеюнума, съдържащ предимно аеробни видове, и гъстата анаеробна популация в дебелото черво. Броят на бактериалните колонии непосредствено над илеоцекалната клапа може да достигне 10(9) колони-формиращи единици (CFU)/mL, с преобладаване на Gram (-) организми и анаероби. В дебелото черво, бактериалната концентрация и разнообразието на ЧМ се променят драстично, до 10(12) CFU/mL или повече. Представени са главно от анаероби, превишаващи броя на аеробите в съотношение от 100 до 1000 : 1. Това състояние отразява факта, че концентрациите на кислород в дебелото черво са много ниски и ЧМ е адаптирана за оцеляване в анаеробната среда3.
Освен микробна хетерогенност по дължината на ГИТ, съществуват вариации в състава, разнообразието и плътността на ЧМ по оста лумен – лигавица. Повечето от бактериалните видове присъстват в чревния лумен (луменна микробиота), докато по-малко, но добре адаптирани видове се прикрепват и пребивават в мукусния слой върху епителните клетки – мукоза-асоциирана микробиота (МАМ)17. Последната най-вероятно участва във взаимодействията с имунната система на организма, докато луменната флора участва главно в метаболитни взаимодействия с храната или с продукти от храносмилането. Очевидно е, че различни бактериални популации могат да обитават тези различни области, но техният относителен принос за здравето и болестите не е напълно изяснен. Една от причините е относителната недостъпност на МАМ в дебелото и особено в тънкото черво. Повечето проучвания на ЧМ се основават на анализи на фекални проби, които дават информация само за луменната флора. В действителност, редица проучвания вече показват разлики между луменната (фекална) ЧМ и МАМ при възпалителните болести на червата и синдрома на раздразненото черво17,18.
Динамичните флуктуации в ЧМ, комбинирани с огромния брой бактериални клетки и тяхната непосредствена близост до епителната тъкан, представляват огромно предизвикателство за имунната система на организма. Освен това, активирането на имунната система на гостоприемника трябва да се контролира, за да се заобиколят вредните ефекти на хроничното възпаление, така че взаимодействието на ЧМ с организма трябва да бъде строго регулирано3,5,19.
Функции на чревната микробиота
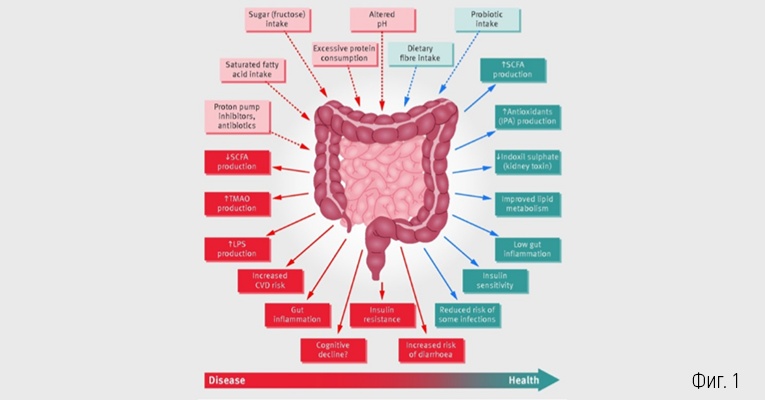
Нормалното взаимодействие между ЧМ и организма е симбиотична, взаимно изгодна връзка. Организмът осигурява богата на хранителни вещества среда за растеж и развитие на ЧМ, а тя от своя страна изпълнява важни за човешкото здраве функции. ЧМ участва в защитата на организма срещу патогенни микроорганизми, в регулацията на метаболитните и трофични функции на епителните клетки и в синтезата на витамини и нутриенти (Фиг. 1)19.
Метаболизъм
В процеса на ко-еволюцията ЧМ се е превърнала от придружаващ коменсал в „метаболитен орган“. Генното разнообразие сред микробната общност осигурява различни ензими и биохимични пътища, поради което ЧМ е способна да поеме метаболитни функции, които допълват човешката физиология. Тъй като метаболитният капацитет на ЧМ е равен на този на черния дроб, ЧМ може да се разглежда като допълнителен (виртуален) орган в ГИT20. Бактериалните дизахаридази разграждат неабсорбираните въглехидрати в храната и ги превръщат в късоверижни мастни киселини (КВМК), основно оцетна, пропионова и маслена киселина. Те се абсорбират бързо в дебелото черво и играят важна роля в регулирането на чревния мотилитет, възпаление, глюкозната хомеостаза и екстракцията на енергия. КВМК са важен енергиен източник за колоноцитите; те са от значение и за стимулиране на техния растеж, а също и за контролиране на процесите на пролиферация и диференциация21. Известно е също, че ЧМ може да произвежда хранителни вещества и витамини, като фолати, витамин К, биотин, рибофлавин и вероятно други витамини от група В; да деконюгира жлъчните соли и да ги конвертира във вторични жлъчни киселини, а също и да метаболизира някои лекарства (като сулфасалазин) в чревния лумен, освобождавайки по този начин техните активни субстанции. Едва наскоро се установи пълният метаболитен потенциал на микробиома и се оценява потенциалният принос на ЧМ към метаболитния статус и здравето на човека, както и връзката със затлъстяването и свързаните с него нарушения19.
Защита срещу патогени и развитие на имунната система
Здравата ЧМ осигурява защитата на организма срещу инвазията на патогени по различни механизми.
Много коменсални чревни микроорганизми произвеждат антимикробни субстанции, с което потискат растежа на патогените, освен това се конкурират с тях за хранителни вещества в лумена и адхезионни места в чревната лигавица. По този начин се предотвратява колонизацията от патогени, феномен, известен като „бариерен ефект“ или „конкурентна ексклузия“ 19,21.
Чревният епител е основната повърхност между мукозната имунна система и външната среда (чревния лумен). Развитието на имунната система се повлиява от непрекъснатите и динамични взаимодействия с ЧМ и нейните метаболити. Бактериите са неразделна част от ранното развитие на имунната система в чревната лигавица, включително нейните физически компоненти и функция, и продължават да играят роля в по-късен етап от живота на човека. Епителните клетки предотвратяват заплахи от патогени чрез сигнализиране на вродената имунна система посредством специфични рецептори, които разпознават и се свързват със специфични компоненти от бактериалната стена. Това води до отключване на имунен отговор и освобождаване на защитни пептиди, цитокини и левкоцити. Резултатът може да бъде защитен отговор към коменсални бактерии или възпалителен отговор към патогенни организми19,21.
Съществуват убедителни доказателства, че ЧМ, наречена още „новия виртуален метаболитен орган“, има важно въздействие не само върху самата физиология на ГИТ, но може да повлияе на функцията на други, екстраинтестинални органи, като черния дроб, мозъка, бъбреците, сърдечно-съдовата система и/или костната система. ЧМ е важен източник на метаболити, хормони и невро-медиатори, които директно регулират чревната функция и индиректно модулират функцията на органите отвъд червото22.
Черво-черен дроб
От физиологична гледна точка, тясната функционална и двупосочна комуникация между червата и черния дроб е една от най-важните връзки между ЧМ и екстра-интестиналните органи. Двата органа „общуват“ широко чрез жлъчните пътища, порталната вена и системните медиатори. Поради уникалната си анатомия и съдовата система, черният дроб получава около 70% от кръвоснабдяването си от червата през порталната вена. Така той непрекъснато е изложен не само на продуктите на храносмилането и абсорбцията, но и на неблагоприятни субстанции от чревния лумен, получени от червата, включително бактерии и бактериални компоненти, като липополизахарид (ендотоксин)23. Черният дроб е важен имунологичен орган и след постъпването на тези субстанции чрез портална циркулация, той реагира с активиране на вродената и адаптивна имунна система с последващото му увреждане. По-доброто разбиране на патофизиологичните връзки между чревната дисбиоза, целостта на чревната бариера и чернодробния имунен отговор към фактори, получени от червата, е от съществено значение за разработването на нови терапии за лечение на хроничните чернодробни болести24.
Черво-мозък
Касае се за двупосочна комуникационна система, която интегрира невронната, хормоналната и имунологичната сигнализации между червата и мозъка. Тя осигурява потенциален път на ЧМ и нейните метаболити за повлияване на мозъчните функции, свързани с емоционалните и познавателни центрове, а от друга страна „позволява“ на мозъка да регулира функциите на ГИТ, като перисталтика и производство на мукус и имунни реакции. През последното десетилетие бе постигнат значителен напредък в разпознаването на важните пътища, по които ЧМ повлиява мозъчната функция. Установено е, че стресът влияе върху целостта на чревния епител и променя перисталтиката, секрецията и производството на мукус, като по този начин променя местообитанието на ЧМ и стимулира нарушения в микробния състав и/или метаболизъм25.
Черво-кожа
Червото и кожата, плътно васкуларизирани и богато иннервирани органи с решаваща имунна и невроендокринна роля, са уникално свързани по предназначение и функция. Като наша основна повърхност с външната среда, и двата органа са от съществено значение за поддържането на физиологичната хомеостаза. Редица болести на ГИТ често са придружени от кожни прояви. Връзката между ЧМ и тяхната потенциална роля в патогенезата на кожните болести е област на изследване, за която ние само започваме да разбираме. Малки проучвания показват съществени промени в ЧМ на пациенти с определени дерматологични болести. Въпреки че механизмите за комуникация между червата и кожата не са напълно разбрани, асоциацията вероятно включва сложна връзка между нервната, имунната и ендокринната система, както и факторите на околната среда26.
Черво-бъбреци
Включва двупосочните взаимодействия между двата органа при пациенти с хронична бъбречна болест. От една страна, уремията засяга както състава, така и метаболизма на ЧМ, а от друга страна, важни уремични токсини са резултат от микробния метаболизъм. В допълнение, чревната дисбиоза може да предизвика нарушаване на епителната бариера, което води до повишена експозиция на организма на ендотоксини. Поради диетичните ограничения и дисфункцията на ГИТ, микробният метаболизъм при хронична бъбречна болест се пренасочва към предимно протеолитична ферментационна структура с образуване на ко-метаболити, с доказана в експериментални и клинични проучвания съдова и бъбречна токсичност. Тези ко-метаболити са привлекателна цел за адювантна терапия при тези пациенти27.
Черво-стави
Коменсалната ЧМ е въвлечена в някои автоимунни болести, вкл. псориазис, псориатичен артрит и ревматоиден артрит. Това са системни автоимунни болести, характеризиращи се с хронично възпаление на ставите и прогресивно увреждане на костите и хрущялите. Комплексните взаимодействия между ЧМ и имунната система могат да доведат до промяна в чревната епителна бариера и до патологично активиране на вродения имунен отговор. Установено е и образуване на нео-епитопи в червата, иницииране на автоимунитет и генериране на автоантитела при пациентите с ревматоиден артрит. Чревната дисбиоза при тези пациенти може да е резултат от изобилие на редки бактериални линии, като Prevotella genus28.
Черво-сърце
ЧМ е идентифицирана като възможен нов рисков фактор за сърдечно-съдови болести, като атеросклерозата и сърдечната недостатъчност. Пациентите със сърдечна недостатъчност имат структурни и функционални промени в чревната лигавица в резултат на микроциркулаторни нарушения. Нарушаването на чревната бариера може да доведе до транслокация на микробни продукти в системно кръвообращение, с възможно утежняване на сърдечната недостатъчност чрез индуциране на възпалителни реакции. По този начин, новата концепция за оста черво-сърце може да доведе до пробиви в разработването на иновативни диагностични и терапевтични подходи при тези пациенти29.
Заключение
Присъждането на Нобеловата награда за физиология и медицина през 2005 на Robin Warren и Barry Marshall напомня, че решението на някои болести не се намира само в рамките на човешкия организъм, а по-скоро може да бъде намерено на границата с микробната среда. Манипулирането на ЧМ се превръща в реалистична терапевтична и профилактична стратегия за много инфекциозни, възпалителни и дори неопластични болести в червата, а също и за болести извън ГИТ. Обещанието за фармакобиотици обаче е малко вероятно да бъде напълно изпълнено, без да се обърне по-голямо внимание на тайните, които се крият в неглижирания вътрешен орган, представен от ЧМ. Тя е богато хранилище на метаболити, които могат да бъдат използвани за терапевтични цели. Следователно дълбокото навлизане в молекулярните детайли на взаимодействията между организма и чревния микробиом е предпоставка за откриването на нови терапевтични възможности за много болести.
Послания за клиничната практика:
1. Човечеството е петънце в необятния бактериален свят. Трябва да свикнем с тази идея.
2. Колекция от микробни общности са еволюирали заедно с homo sapiens, за да помогнат в оркестрирането на основни жизнени процеси, започващи в момента, в който сме родени.
3. Съставени сме от 90% бактерални и 10% човешки (еукариотни) клетки – дали наистина сме хора или ходеща бактериална колония?
4. Гените, кодирани от бактериалния геном, превишават около 150 пъти гените, кодирани от човешкия геном.
5. Чревната микробиота е най-важната микроекосистема, живееща в симбиоза с човешкия организъм и изпълняваща ключова роля в много физиологични и патологични процеси.
6. От неглижиран орган, чревната микробиота се превърна във важен метаболитен орган – ключът към нашето здраве.
Литература:
1. Dave M, Higgins P, Middha S et al. The human gut microbiome: current knowledge, challenges and future directions. Translational Res 2012; 160: 246-57.
2. Cani P, Delzenne N. The gut microbiome as therapeutic target. Pharmacol Ther 2011;130:202-12.
3. Guarner F, Malagelada JR. Gut flora in health and disease. Lancet. 2003; 361(9356):512–519.
4. Structure, function and diversity of the healthy human microbiome. Human Microbiome Project Consortium. Nature 486, 207–214 (2012).
5. Lloyd-Price J, Abu-Ali G, Huttenhowe C. The healthy human microbiome. Genome Med. 2016; 8: 51.
6. Tap J, Mondot S, Levenez F et al. Towards the human intestinal microbiota phylogenetic core. Environ. Microbiol. 2009, 11: 2574–2584.
7. Hooper LV, Gordon JI. Commensal host-bacterial relationships in the gut. Science. 2001, 292: 1115–1118.
8. Ursell LK, Haiser HJ, Van Treuren W et al. The intestinal microbiome: an intersection between microbiota and host. Gastroenterology 2014, 146 (6); 1470-6.
9. Isolauri E. Development of healthy gut microbiota early in life. J Pediatr Child Health. 2012,48, Suppl 3:1-6.
10. Thursby E, Nathalie J. Introduction to the human gut microbiota. Biochem J. 2017; 474: 1823–1836.
11. Tanaka M, Nakayama J. Development of the gut microbiota in infancy and its impact on health in later life. Allergology International. 2017; xxx:1-8
12. Collado MC, Isolauri E, Laitinen K et al. Effect of mother‘s weight on infant‘s microbiota acquisition, composition, and activity during early infancy: a prospective follow-up study initiated in early pregnancy. Am J Clin Nutr. 2010; 92(5):1023-30.
13. Backhed F. Programming of host metabolism by the gut microbiota. Ann Nutr Metab. 2011;58(suppl 2):44–52.
14. Palmer C, Bik EM, DiGiulio DB et al. Development of the human infant intestinal microbiota. PLoS Biol. 2007; 5(7):e177.
15. Fernández LB, Cohen H, Guarner F et al. Human gut microbiota – A lifetime history: from birth to adulthood. Acta Gastroenterol Latinoam 2016;46:375-38
16. O’Hara AM Shanahan F. The gut flora as a forgotten organ. EMBO Rep. 2006; 7(7): 688–693.
17. Swidsinski A, Weber J, Loening-Baucke V et al. Spatial organization and composition of the mucosal flora in patients with inflammatory bowel disease. J Clin Microbiol. 2005;43 (7):3380–3389.
18. Carroll IM, Ringel-Kulka T, Keku TO, et al. Molecular analysis of the luminal-and mucosal-associated intestinal microbiota in diarrheapredominant irritable bowel syndrome. Am J Physiol Gastrointest Liver Physiol. 2011; 301(5): G799–G807.
19. Jandhyala SM, Talukdar R, Subramanyam C et al. Role of the normal gut microbiota. WJ Gastroenterol 2015; 21(29): 8787-8803.